Argomenti
1. Introduzione
2. Breve storia dell'immunologia
3. Il controllo genetico della risposta immune
4. La risposta immune
5. La milza nell'immunità adattiva
6. Risposta immune Th1, Th2, Th3 e Th17
7. L'immunotolleranza
8. La risposta autoimmune
Conclusione
Bibliografia
1. Introduzione. (
Torna Su)
Il cammino progressivo che ha condotto alle attuali conoscenze sul sistema immunitario è una storia affascinante. In questa breve rassegna riassumerò le tappe essenziali che hanno portato all' odierno concetto di immunità adattiva. Descriverò poi gli aspetti fondamentali, comuni alle differenti malattie croniche autoimmuni. Il mio scopo è di aiutare sia medici che pazienti a comprendere queste malattie, e contribuire alla migliore collaborazione possibile tra loro.
Nei miei ultimi anni di università alla Facoltà di Medicina di Zurigo (1948/1949), l' insegnamento dell' immunologia si limitava alle basi della vaccinazione e alla sierologia dei gruppi sanguigni. Il sistema Rhesus (Rh) di recente scoperta lasciava gli studenti con più domande che risposte. L' argomento dell' autoimmunità non era mai menzionato.
Quando iniziai le mie ricerche sulle malattie autoimmuni nel 1950, gli altri colleghi non comprendevano il mio interesse sull'argomento. All' epoca, l'autoimmunità era considerata un evento estremamente raro. Negli oltre 50 anni successivi la situazione è drasticamente cambiata. In realtà oggi le malattie autoimmuni colpiscono almeno il 5% della popolazione generale.
Fra oltre 1000 rilevanti contributi, ho selezionato poche referenze-chiave che hanno avuto un impatto sulla mia intelligenza dei fenomeni, e che possono essere utili per medici e pazienti.
Il medico ha il difficile compito di dirigere il trattamento di una malattia autoimmune cronica che dipende da fattori genetici, variabili da paziente a paziente, e fattori ambientali, variabili nel corso della malattia.
Il paziente deve collaborare attivamente col medico nella gestione della propria malattia. Per assumere questa corresponsabilità, egli ha bisogno di essere familiare con la natura della sua malattia così come col ruolo dei diversi farmaci usati nel trattamento. Una stretta e duratura collaborazione tra paziente e medico è essenziale per il successo della cura.
Poiché le interazioni cellulari di base nell' autoimmunità (cioè l' immunità contro autoantigeni) non sono diverse da quelle implicate in qualsiasi reazione immune, occorre prima occuparsi della reazione antigene-anticorpo tipica, non-autoimmune.
2. Breve storia dell'immunologia. (
Torna Su)
L' immunità è uno stato di protezione dall' aggressione esterna di fattori come infezioni e tossine.
La vaccinazione, cioè l' induzione di immunità nei confronti di una malattia specifica, era già applicata nell' antichità in Cina, India e Persia, in tempi di totale ignoranza circa la natura delle diverse malattie. In Occidente, Edward Jenner introdusse nel 1796 la vaccinazione contro il vaiolo strofinando le pustole del vaiolo delle mucche sulla pelle dei soggetti, perchè divenissero protetti contro il virulento vaiolo umano (1). La sua procedura era basata sull'osservazione che il meno tossico vaiolo vaccino conferiva protezione contro il virulento vaiolo umano (Il termine vaccinazione origina dal latino "vacca").
Quasi 100 anni più tardi, Emil Von Behring e Shibasaburo Kitasato (2) riferirono della formazione di una specifica "antitossina" in cavalli vaccinati con tossina difterica. Lo stato di immunità anti-difterite poteva essere trasferità a cavalli non immunizzati con l' iniezione del siero di cavalli vaccinati, una procedura fin da allora conosciuta come "immunizzazione passiva". Von Behring coniò il termine "antitossina", il che rappresenta la prima descrizione di un anticorpo specifico. Con questa scoperta si apriva la strada a ulteriori ricerche sugli "anticorpi", già con la domanda se potessero prodursi anticorpi contro costituenti propri ("self") di un organismo.
Nel 1900, Sergei Metalnikoff (3) pubblicò i suoi esperimenti su autoanticorpi contro gli spermatozoi. Questa pubblicazione spinse Paul Ehrlich e Julius Morgenroth (4) ad affrontare la questione, attraverso l' immunizzazione di capre con eritrociti di altre capre. Con questi esperimenti Ehrlich poté individuare vari anticorpi contro eritrociti di diverse capre, ma mai anticorpi contro gli eritrociti autologhi. Egli concluse per l' esistenza nelle capre di differenti "gruppi sanguigni", identificati da cosiddetti "isoanticorpi", cioè anticorpi prodotti da un membro della stessa specie di quello da cui proveniva l'agente immunizzante, o "antigene". Con l' espressione "horror autotoxicus" designò l'avversione di un individuo - animale o persona - a produrre autoanticorpi contro i propri antigeni cellulari o tessutali.
Un anno più tardi (1901), Karl Landsteiner (5) descrisse il sistema dei gruppi sanguigni umani ABO, basato sulla presenza di isoanticorpi contro i gruppi sanguigni diversi dal proprio, cioè isoanticorpi anti B in persone A+, isoanticorpi anti A in persone B+, iso sia anti A che anti B in persone di emogruppo O.
Qualche anno dopo (1907), Clemens von Pirquet (6) descrisse la "reazione cutanea ritardata" di soggetti tubercolosi dopo iniezione intradermica di tubercolina ("reazione cutanea alla tubercolina"). Quasi 40 anni dopo (1945), Merrill Chase (7) pubblicò i suoi esperimenti sul trasferimento passivo della reattività tubercolinica mediante linfociti, aprendo così il campo dell' immunità cellulare contro quella umorale.
L' interesse per i linfociti crebbe dopo che nel 1948 Astrid Fagreus scoprì l' origine cellulare degli anticorpi, nei plasmociti (8). Con l' introduzione dell' elettroforesi del siero, gli anticorpi vennero individuati nella "frazione delle gammaglobuline", e chiamati in accordo "immunoglobuline". Gli anni successivi permisero di riconoscere differenti tipi di immunoglobuline (Ig) con differenti funzioni: IgM, anticorpi ad alto peso molecolare coinvolti sia nell'immunità innata, o "naturale", sia in quella adattiva; IgG, le classiche Ig adattive, la cui formazione fa seguito in genere a quella delle IgM nel processo di immunizzazione; anticorpi IgA e IgE, coinvolti nell' immunità delle mucose. Infine l' IgD, che è presente nel siero solo in quantità residuali, ed è principalmente coespresso con IgM sulla superficie di molti linfociti, ma non delle cellule secernenti anticorpi. Le molecole degli anticorpi hanno tutte una struttura di base di quattro catene poliptidiche, consistente in due identiche catene leggere (L, light) e due identiche catene pesanti (H, heavy). Inoltre, nella struttura molecolare degli anticorpi distinguiamo una regione costante e una variabile o antigene-specifica. La prima ha una porzione C-terminale detta Fc, che lega la frazione C1q del complemento o i cosiddetti recettori Fc di vari tipi di cellule. La seconda è codificata da una serie cospicua di geni V.
Nel 1955, Bruce Glick e Timothy Chang (9) descrissero la Borsa di Fabrizio, che nei polli è uno speciale organo linfatico, responsabile dello sviluppo dei linfociti circolanti. I linfociti Borsa-derivati sono preposti alla produzione degli anticorpi. Sebbene la ricerca nell' uomo di un organo Borsa-equivalente non abbia avuto esito, i linfociti formanti anticorpi sono ora chiamati linfociti B. 5 anni dopo, Jacques F.A.P. Miller (10) scoperse il ruolo fondamentale del timo, un organo linfatico essenziale per lo sviluppo dei linfociti timo-derivati (linfociti T).
Il trapianto d' organo è sempre stato una materia intrigante per ricercatori e clinici. Quando ho descritto nel 1954 (11) l' esistenza di gruppi leucocitari nell' uomo, non prevedevo il profondo impatto che avrebbe poi avuto il raggruppamento dei leucociti sulla medicina dei trapianti. Jean Dausset (12) in Francia e Jon van Rood (13) in Olanda elaborarono il raggruppamento completo dei leucociti, conducendo al sistema HLA (human leukocyte antigen). Alla fine la tipizzazione HLA si dimostrò essenziale per il successo del trapianto. La funzione del sistema HLA nella lotta per la sopravvivenza individuale non è certamente il controllo del trapianto, piuttosto la sorveglianza dell' intero ambiente interno dell' ospite attraverso il riconoscimento del non proprio ("non-self") come diverso dal proprio ("self"). In altri vertebrati il sistema analogo all'HLA è noto come complesso maggiore d'istocompatibilità (MHC, major histocompatibility complex).
La maggiore tappa successiva nella nostra comprensione dell' immunità adattiva è stata nel 1972 la scoperta di Baruj Benacerraf e Hugh O. McDevitt del controllo genetico della risposta immune, da parte di geni collegati all' MHC (14). Con questa scoperta Benacerraf creò una nuova prospettiva per l' MHC. Negli anni seguenti, la tipizzazione HLA individuò modelli associati a diverse malattie, osservazione che ha introdotto l' immunogenetica nella medicina clinica.
Esistono due classi di proteine transmembrana MHC, con ruoli differenti nell'immunosorveglianza. Le molecole di classe I sono tipicamente implicate nel riconoscimento di patogeni intracellulari come i virus, mentre quelle di classe II sono importanti per la risposta agli antigeni extracellulari, e specialmente nell'autoimmunità. L'espressione della classe II MHC è essenziale per la funzione delle cellule presentanti l'antigene (APC, Antigen-presenting cell), che comprendono differenti tipi di cellule dendritiche, macrofagi tissutali attivati, monociti e cellule B attivate. Queste cellule sono in prima linea nelle interazioni cellulari che vengono oggi ritenute di centrale importanza nelle malattie autoimmuni. Nelle specie primitive unicellulari e in organismi pluricellulari semplici come le spugne marine, il riconoscimento cellulare può essere mediato da molecole di adesione ancestrali simil-HLA, le cui funzioni possono essere perturbate da agenti nocivi. In organismi più avanzati si sono evolute linee cellulari specializzate, con funzioni differenti e complementari. Lo sviluppo delle APC e l'interazione di queste coi linfociti diede luogo a un doppio sistema di riconoscimento, come accade nell'uomo. Noi ora comprendiamo come l'immunità anticorpo-mediata sia sotto il controllo della sorveglianza MHC-dipendente. In effetti, senza il sistema MHC il numero praticamente illimitato di specificità anticorpali produrrebbe effetti dannosi.
Con la scoperta dei geni della risposta immune, noti anche come "geni di istocompatibilità", si sono gettate le fondamenta dell' odierno concetto di immunità adattiva. Le successive decadi portarono un' immensa mole di informazioni sul funzionamento della rete immunitaria cellulare. Markers cellulari di superficie sono stati descritti su linfociti, macrofagi e cellule endoteliali, conducendo al sistema CD (Cluster of Differentiation, da CD 1 a oltre CD 100). Sono state scoperte più di 100 citokine, implicate nelle interazioni cellulari e nell' infiammazione dei tessuti.
La caratterizzazione dei linfociti timo-derivati coinvolti nel riconoscimento antigenico MHC-relato, vale a dire le cellule T, progredì rapidamente in seguito alla clonazione di diversi tipi di recettori cellulari T (TCR, T cell receptor). Questi TCR sono proteine transmembrana eterodimeriche immunoglobulina-relate, con domini costanti e variabili. Essi si associano ai polipeptidi del complesso cellulare di segnalazione CD3, e sembra si aggreghino in strutture con quattro polipeptidi TCR, abbastanza simili alle IgD di superficie cellulare. Vi fu poi la caratterizzazione di sottogruppi di timociti e di linee cellulari T funzionalmente distinte, tra cui le cellule Th1 e Th2, le prime coinvolte nella lotta contro le infezioni intracellulari, le seconde in quella contro le infezioni associate all'immunità anticorpo-mediata (15). Oggi il campo é stato ulteriormente arricchito col riconoscimento di varie popolazioni di cellule T regolatorie (definite Treg), che inibiscono funzioni di altre cellule T. Di recente è stato anche scoperto il sistema Th17 (16). Esso ha probabilmente la funzione di combattere le infezioni croniche extracellulari, e ha un ruolo in malattie autoimmuni come sclerosi multipla, LES e artrite reumatoide. Di pari passo con tali progressi sono stati sviluppati nuovi farmaci immunomodulanti, attivi verso tappe specifiche della risposta immune.
3. Il controllo genetico della risposta immune. (
Torna Su)
Per comprendere il controllo genetico della risposta immune (RI), per prima cosa osserviamo più da vicino la natura degli antigeni. All' interno di un antigene proteico possono esservi uno o più determinanti antigenici. Questi possono essere riconosciuti da uno dei molti linfociti disponibili nell' enorme preesistente repertorio di T e B linfociti, ciascuno dei quali esprime una sola singola specificità. Ma questo repertorio non può essere usato se le APC non fagocitano l'antigene, lo processano con la proteolisi e mostrano i frammenti peptidici così ottenuti sulla propria superficie cellulare, a stretto contatto coi T-linfociti. I frammenti peptidici dell'antigene proteico sono legati in una nicchia di molecole MHC, dove possono essere riconosciuti solo dai T-linfociti che possiedono un recettore TCR specifico sia per quel particolare determinante antigenico che per le parti adiacenti di quella precisa molecola MHC. Abbiamo pertanto a che fare con un duplice riconoscimento dell' antigene, per il quale sono necessarie sia le cellule APC che quelle T (fig.). Solo una minoranza di frammenti peptidici è in grado di legarsi alle proteine MHC, e indurre così una RI. Solo questi frammenti costituiscono i determinanti antigenici immunogeni.
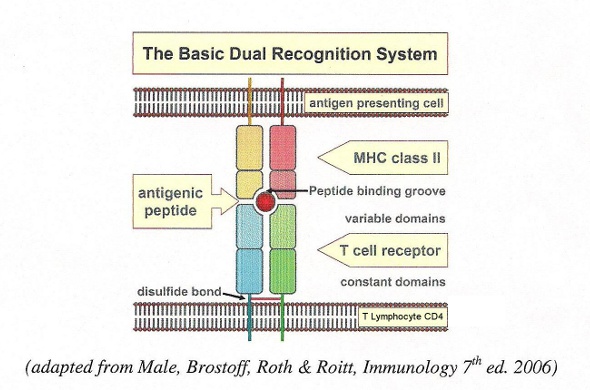
Le molecole MHC sono altamente polimorfe. Nell'uomo sono codificate da una porzione del cromosoma 6 con notevole variabilità allelica. Questa sottoregione del cromosoma 6 codifica per diversi altri importanti componenti del sistema immunitario. I geni della classe II MHC, particolarmente importanti nelle risposte autoimmuni, sono situati nel locus D del cromosoma 6, che - fatto degno di nota - contiene anche alcuni dei geni coinvolti nella processazione dell'antigene. Non è dunque sorprendente il fatto che molte malattie autoimmuni siano geneticamente associate a particolari geni di classe II MHC. I meccanismi di queste associazioni sono attualmente oggetto di un'intensa attività di ricerca. Analogamente al meccanismo di presentazione dell'antigene ai linfociti T CD4, i linfociti T citotossici (CD8) riconoscono l'antigene bersaglio (ad esempio un virus) associato a molecole MHC di classe I (MHC restricted lymphotoxic action, azione linfotossica MHC-dipendente) (14a).
4. La risposta immune. (
Torna Su)
L' immunità innata rappresenta la prima linea di difesa contro i microbi, senza necessità di una precedente immunizzazione. L'immunità innata (o naturale) lavora fianco a fianco con l'immunità adattiva, cioè l'immunità specificamente adattata contro un dato patogeno, che però richiede una fase iniziale di immunizzazione "adattiva" prima di offrire piena protezione. La dinamica dell'immunità adattiva antigene-specifica è essenziale per combattere le infezioni. La descrizione seguente verte sull'immunità adattiva.
Una risposta immune (RI) è iniziata dalle APC (cellule presentanti l' antigene), che presentano i determinanti antigenici ai T-linfociti. APC fagocite come le cellule dendritiche o i macrofagi inglobano e digeriscono il materiale antigenico, per poi esporre i frammenti peptidici delle proteine antigeniche sulla superficie cellulare insieme alle molecole della classe II MHC. Una forma peculiare di presentazione dell'antigene è quella attuata dai linfociti B. Il legame degli antigeni alle Ig sulla propria superficie cellulare (B cell receptor) risulta in un'endocitosi recettore-mediata, seguita da degradazione proteolitica e presentazione MHC-associata sulla superficie cellulare come per le altre APC. Il risultato di queste due forme differenti di presentazione dell'antigene è di amplificare una RI, coinvolgendo un numero crescente di APC, cellule T e cellule B.
Strutture linfatiche specifiche presenti in tutto il corpo facilitano l'interazione cellulare tra APC, cellule T e cellule B. Una vasta rete di linfonodi rappresenta il sistema regionale della difesa immunitaria adattiva. I linfociti abbandonano il circolo sanguigno migrando attraverso la parete di venule specializzate. Entrano quindi in piccoli vasi linfatici, dove vengono drenati microbi e qualsiasi materiale tossico, per raggiungere infine i linfonodi regionali, dove ha luogo l'effettiva RI. In seguito i linfociti lasciano i linfonodi, ancora tramite vasi linfatici che conducono infine nel sangue. Le cellule ricircolanti dei linfonodi del tronco, organi interni e arti inferiori passano attraverso il dotto toracico nella vena succlavia sinistra. Il dotto linfatico destro drena la porzione superiore destra del corpo. Nel caso di una RI contro un antigene, l'interazione cellulare tra APC e linfociti T e B causa un' espansione clonale di linfociti T e B antigene-specifici, che determina un aumento delle dimensioni del linfonodo. Alla palpazione, il linfonodo ingrossato è molle e sensibile. La RI nei tessuti linfoidi non capsulati delle aree sottomucose dei sistemi respiratorio, gastrointestinale e urogenitale protegge i siti esposti dall' ingresso di agenti patogeni.
Il sistema nervoso centrale (SNC) è ben protetto dalla parte somatica del corpo grazie alla barriera emato-encefalica (BBB, Blood-Brain Barrier). In caso di infezione, i linfociti oltrepassano la BBB e si accumulano in piccoli grappoli linfofollicolari, dove le interazioni cellulari permettono l' avvio della RI contro l' agente infettivo.
5. La milza nell' immunità adattiva. (
Torna Su)

La milza è un organo capsulato emo-linfoide situato nella parte sinistra del cavo addominale, sotto il diaframma e dietro lo stomaco. Si compone di due compartimenti: la polpa rossa, la sua parte interna, che è parte integrante del sistema emopoietico, e la polpa bianca nella parte esterna.
La polpa bianca è un organo linfoide con una struttura interna atta a facilitare le interazioni cellulari implicate nella RI. Pertanto, la valutazione clinica della milza è essenziale per individuare una risposta immune in atto nella sua polpa bianca.
La misurazione complessiva delle dimensioni spleniche effettuata dall' ecografia tradizionale non permette di valutare accuratamente i cambiamenti della polpa bianca. La polpa bianca ha una zona di contatto diretto con la parete toraco-addominale. La lunghezza verticale dell' area di contatto lungo la linea medioascellare misura normalmente da 5 a 6 cm per tutta la durata della vita adulta. Questa lunghezza è misurabile con la percussione manuale, tecnica che però non è accettabile per la misurazione oggettiva della milza. Ma in anni recenti è stato possibile valutare accuratamente la lunghezza del contatto tra milza e parete toraco-addominale mediante l' ecografia lineare (17), usando una sonda lineare da 8 a 10 cm. Analogamente ai linfonodi, la polpa bianca della milza cresce di dimensioni nel caso di una RI in atto, provocando un aumento della superficie di contatto parietale (7-14 cm). A seconda dell' intensità della componente infiammatoria della RI, la milza può essere dolorabile alla percussione, a meno che il paziente non sia sotto terapia cortisonica. La milza è impegnata ogniqualvolta un antigene - endogeno o esogeno - passa attraverso la sua polpa bianca. Di conseguenza, la milza è allargata nella setticemia così come in certe malattie virali, soprattutto la mononucleosi infettiva.
Per quanto riguarda le malattie autoimmuni (RI contro autoantigeni), la polpa bianca splenica è coinvolta in tutte le collagenopatie sistemiche (non-localizzate). Nei pazienti con artrite reumatoide - che è la collagenopatia sistemica più frequente -, il primo segno di attività di malattia è una milza ingrossata, generalmente anche sensibile alla percussione. La lunghezza del contatto spleno-parietale è di primaria importanza per la gestione di tutti i pazienti con malattie autoimmuni sistemiche.
6. Risposta immune Th1, Th2, Th3 e Th17. (
Torna Su)
Il primo tentativo di distinguere tra differenti tipi di risposte immuni portò alla definizione di RI Th1 e Th2, cioè RI cellulare contro umorale (Mosmann e al., 1986). Con la scoperta di un numero crescente di markers di differenziazione cellulare (CD) e di citokine (interleuchine, IL), si poterono riconoscere ulteriori tipi di risposte immuni.
Gli agenti patogeni erano un tempo ritenuti responsabili della selezione del tipo di RI. Riguardo al Th1, certi microrganismi patogeni, penetrati in una cellula, possono essere affrontati dai recettori del sistema di immunità innata (18), per esempio attraverso l' azione dei recettori tipo NOD (nucleotide-binding oligomerization domain), che produce il rilascio di citokine pro-infiammatorie, che a loro volta indirizzano la RI adattiva verso la classe Th1.
La RI Th2 ha probabilmente origine nei linfonodi e nella milza sotto l' influenza delle IL4 e IL10, con l' effetto di produrre immunoglobuline fissanti il complemento (IgG). Contemporaneamente, l' IL10 inibisce la classe Th1 dell' immunità cellulare. Questa "immunità umorale" è impegnata nella lotta contro i patogeni extracellulari.
Le potenti citokine infiammatorie della RI Th1, insieme con le citokine pro-infiammatorie interferone gamma e fattore di necrosi tumorale (TNF), sono idonee a combattere un' infezione acuta. Ma una reazione infiammatoria così intensa potrebbe essere deleteria in certi tessuti, come le mucose del tratto gastrointestinale e di quello respiratorio.
Che cosa è responsabile della "selezione tessutale" della RI? Per tessuti delicati come le mucose, Polly Matzinger (19) postula una "educazione tessutale specifica" della RI per l' aggiustamento a seconda del tessuto da proteggere. Come conseguenza di una simile educazione tessuto-specifica per la protezione immunitaria delle mucose respiratoria e gastrointestinale, l' autrice ha individuato la risposta Th3, mediata dal transforming grouth factor beta e dall' IL10, il secondo dei quali sopprime una RI Th1 potenzialmente dannosa.
La RI Th3 ha per risultato la produzione di anticorpi IgA da parte delle cellule B implicate nella RI della mucosa. Le IgA non fissano il complemento, componente flogogeno legato al complesso antigene-anticorpo, e così proteggono la mucosa dall' aggressione microbica con una infiammazione minima.
Più di recente, una RI iniziata dal transforming grouth factor beta + IL6 è stata descritta in certi modelli sperimentali di malattie autoimmuni (encefalomielite autoimmune e artrite collageno-indotta). Le cellule T responsabili di queste malattie sperimentali producono un' IL chiamata IL17. Di conseguenza, questa nuova classe di RI è stata definita RI Th17 (16). La RI Th17 sembra essere implicata nella lotta contro le infezioni batteriche croniche extracellulari. Ma è d' interesse osservare come sia anche implicata in malattie quali artrite reumatoide e sclerosi multipla.
Nella selezione della classe Th, la funzione delle APC non si limita alla presentazione dell' antigene ai T-linfociti. In realtà, le APC svolgono un ruolo centrale nella selezione del tipo di RI. Subito prima di entrare nelle strutture linfatiche (linfonodi, milza etc.) queste cellule emettono tentacoli citoplasmatici e diventano "cellule dendritiche" (DC, "Dendritric Cells"). Tale trasformazione aumenta la superficie disponibile per le interazioni cellulari. Oltre alla presentazione degli antigeni ai T-linfociti, le DC assumono una funzione cruciale come regolatrici dell' immunità tessuto-specifica, che comprende la loro capacità di indurre immunotolleranza, cioè uno stato di "non-reattività" verso un dato antigene (20). Le DC sono in tal modo corresponsabili per la classe di RI in un determinato organo.
La distinzione della RI in differenti classi è importante per la comprensione dei meccanismi implicati nelle malattie sia infettive che autoimmuni. Ma in realtà diverse RI si sviluppano simultaneamente o in sequenza. Non è pertanto realistico parlare di malattie Th1, Th2 o Th3-relate. In generale, più di una classe di RI è impegnata in una data malattia.
7. L'immunotolleranza. (
Torna Su)
La tolleranza immunologica rappresenta uno stato di non-responsività nei confronti di una molecola riconoscibile dal sistema immunitario. In condizioni normali le molecole "self" non suscitano una risposta immune, e l' organismo sano non è colpito dall'"autoimmunità". La "self"-tolleranza fa riferimento all' acquisizione di tolleranza durante lo sviluppo dei linfociti nel periodo neonatale. E' allora che le cellule T self-reattive vengono distrutte nel timo. Questo controllo del sistema immunitario è stato considerato pressoché perfetto per mezzo secolo, con poche eccezioni riconosciute, come ad esempio l' anemia emolitica autoimmune.
Negli anni '50-'60, ogni convegno sull' autoimmunità era vissuto con un criticismo estremo, e si pretendevano numerose condizioni, compresi modelli sperimentali riproducenti una particolare malattia, prima che per la sua origine un meccanismo autoimmune fosse considerato una spiegazione accettabile .
L' ematologia è un campo più facilmente accessibile di altri per le ricerche immunologiche, poiché riguarda le cellule del sangue circolante e non quelle di tessuti strutturalmente più complessi. Anziché la biopsia di un tessuto, è sufficiente per l' indagine un semplice prelievo di sangue. In seguito alla descrizione di Anatole Chauffard (21) di rari casi di anemia emolitica autoimmune, l' introduzione da parte di Robert Royston Amos ("Robin") Coombs del test all' antiglobulina per l' individuazione di immunoglobuline sulla superficie degli eritrociti permise di trovare cellule rivestite di gammaglobuline nei pazienti con anemia emolitica autoimmune (22).
Riguardo alle piastrine, William Harrington dimostrò l' eliminazione di piastrine da parte di un fattore sierico piastrina-specifico (23). Di fatto egli si iniettò il plasma di un paziente affetto da una severa forma di porpora tromboctopenica idiopatica (ITP). In seguito al suo eroico esperimento sviluppò una porpora trombocitopenica così severa che dovette essere ospedalizzato. Pochi anni più tardi, abbiamo dimostrato la presenza di un fattore anti-piastrina in pazienti con ITP, un fattore che potevamo adsorbire su normali piastrine lavate (24). Successivamente abbiamo descritto un autoanticorpo contro i neutrofili in un paziente con leucopenia cronica, ancora con la dimostrazione che l' anticorpo, una gammaglobulina, poteva essere adsorbita su leucociti intatti lavati (25).
Nel 1948, Malcolm Hargraves (26) dimostrò, nel midollo osseo di un paziente affetto da lupus eritematoso sistemico (LES), la presenza di cellule (neutrofili e monociti) con nel citoplasma una massa tonda, amorfa, che spingeva il nucleo da un lato. Egli chiamò queste cellule "cellule LE". Fortunatamente per la scoperta del fenomeno delle cellule LE, il paziente era in un ospedale a circa 30 minuti dalla Mayo Clinic. Così Hargraves tenne l'aspirato di midollo in un tubo eparinato, che portò nella giacca fino al laboratorio della Mayo. Quei 30 minuti di incubazione a contatto col corpo permisero alle cellule di sopravvivere e quindi formare cellule LE.
Si fecero molte speculazioni sulla natura delle cellule LE. John Haserick mostrò che la cellula LE è causata da una gammaglobulina (27). In seguito ai miei studi sugli autoanticorpi nell' ITP e nella leucopenia cronica io postulai un meccanismo analogo per la formazione delle cellule LE. In particolare sospettai una fagocitosi di materiale nucleare indotta da un anticorpo. Così nel 1954 iniziai a separare nuclei cellulari dal citoplasma di timociti di vitello, allo scopo di produrre anticorpi contro il nucleo cellulare. Per raggiungere tale scopo, immunizzammo delle cavie con nuclei cellulari. Questi animali effettivamente produssero anticorpi antinucleari che condussero alla formazione di nucleofagocitosi dopo incubazione con leucociti umani. Conducemmo quindi esperimenti di assorbimento con il siero di pazienti LES. Solo l' incubazione dei sieri LE con nuclei cellulari isolati di timociti di vitello aboliva la capacità dei sieri LE di formare cellule LE. L' incubazione con timociti intatti non provocava l' adsorbimento del fattore antinucleare (28). In seguito dimostrammo nel siero di pazienti LES anticorpi anti-nucleoproteina, responsabili della formazione di cellule LE, e anche anticorpi contro il DNA nativo (29). Poiché questi anticorpi non potevano essere adsorbiti su cellule intatte, ma soltanto su nuclei cellulari isolati, essi non potevano essere direttamente responsabili del danno cellulare o tessutale. Gli stessi anticorpi divenivano invece patogenici sotto forma di complessi antigene-anticorpo, in modo simile al meccanismo della vasculite nella malattia da siero sperimentale.
La domanda su che cosa provochi la formazione di autoanticorpi contro componenti intracellulari ha di recente trovato una risposta con la dimostrazione in pazienti LES di una anormale "apoptosi" (morte cellulare programmata), che conduce alla fosforilazione patologica di proteine "self" da parte dell' enzima serina/treonina kinasi. Gli antigeni "self" modificati che ne risultano sono riconosciuti dai sieri di pazienti con LES. Il processo di degradazione durante l' apoptosi crea proteine "self" modificate che sfuggono al controllo della tolleranza (30).
Oggi ulteriori dati indicano che in certe malattie autoimmuni, come ad esempio l' artrite reumatoide (AR), è coinvolta la produzione di anticorpi contro "self"-proteine "modificate", che per conseguenza risultano reattivi anche contro le analoghe "self"-proteine non modificate. Nell'AR la RI è diretta contro proteine citrullinate presenti nella membrana sinoviale infiammata di un' articolazione colpita. La citrullinazione delle proteine ha dimostrato di poter rompere la tolleranza nel topo. La modificazione post-traduzionale delle "self"-proteine appare così essere un meccanismo più generale nel processo di "autoimmunizzazione" (31).
Tuttavia, il segreto dell' autoimmunità non è limitato alla modificazione post-traduzionale delle "self"-proteine. Ora noi sappiamo che la predisposizione a contrarre una data malattia autoimmune coinvolge un complesso background genetico. Iniziando dal controllo genetico della RI, ci occupiamo per prima cosa dei geni dell'MHC, cioè del riconoscimento di un immunogeno da parte delle APC. Non sorprende il fatto che geni codificanti per il TCR rappresentino un'altra predisposizione genetica, perché il recettore delle cellule T deve corrispondere al complesso presentato sulla superficie delle APC.
In anni recenti, sono stati dimostrati fattori di predisposizione genetica addizionali, coinvolti nell' espressione di una data malattia autoimmune. Ora in effetti distinguiamo una specificità oligogenetica per il tipo di malattia autoimmune (AR, LES, psoriasi etc.), e una moltitudine di geni modificanti la malattia coinvolti nell' espressione clinica di questa.
8. La risposta autoimmune. (
Torna Su)
I meccanismi implicati nelle RI contro antigeni "self" non sono differenti da quelli di una RI contro antigeni "non-self". In entrambe le condizioni, la localizzazione della RI dipende dalla sede dell' aggressione da parte del presunto antigene. Così una faringite batterica produce una RI nei linfonodi regionali cervicali, un' infezione batterica sistemica (sepsi) o un' infezione sistemica virale (es. la mononucleosi infettiva) provocano una RI nella polpa bianca della milza.
Occupiamoci per prima cosa dei disordini autoimmuni localizzati.
Nel caso della sclerosi multipla (SM), l' effettiva risposta immune ha luogo nel sistema nervoso centrale (SNC). I linfociti antigene-specifici sono presenti anche in questo caso nel sistema immunitario somatico, che è responsabile della predisposizione di lungo periodo alla malattia. La malattia vera e propria richiede il trasferimento dei linfociti T e B SM-specifici dal compartimento somatico a quello del SNC. Un passaggio di questo tipo non avviene in condizioni normali. E' stato dimostrato che vari eventi possono contribuire alla rottura della barriera ematoencefalica (BBB), per esempio infezioni, stress o traumi psichici. Quando tali eventi sono circoscritti al SNC non è apprezzabile alcun ingrossamento della milza.
La psoriasi è un' altra condizione autoimmune localizzata nella quale piccole lesioni cutanee non rilasciano nel sangue circolante una quantità di autoantigeni sufficiente a coinvolgere la milza nella RI. Ma in una forma generalizzata di psoriasi passa nel circolo sanguigno una sufficiente quantità di materiale autoantigenico, deteminando una RI nella polpa bianca della milza con incremento delle dimensioni di quest' ultima. La lesione cutanea psoriasica è prodotta da T-linfociti specifici.
La morfea, una forma di sclerosi sistemica limitata a determinate aree cutanee, è un altro esempio di una condizione localizzata correlata a una malattia autoimmune sistemica. Come nella psoriasi, una morfea occupante un' area relativamente piccola può non produrre un' autoantigenemia specifica sufficiente a sollecitare una RI nella milza. Tuttavia, se la lesione diviene più estesa, è probabile che il presunto autoantigene passi nel circolo ematico e dia così inizio a una RI splenica.
La malattia di Crohn, un' altra condizione autoimmune "localizzata" che provoca severe lesioni infiammatorie nell' ileo terminale, porta sempre a una RI nella polpa bianca della milza, probabilmente a causa della facilità per l' autoantigene di passare dall'intestino nel circolo sanguigno. La milza ingrossata è di fatto il segno più affidabile di attività immunologica in questa potenzialmente invalidante condizione. L' infiammazione cronica dell' ileo terminale può portare a una severa stenosi dell' ileo, tale da richiedere una correzione chirurgica. Dopo l' intervento, il paziente ritiene curata la sua malattia, laddove invece il processo morboso continua, col rischio della formazione di una nuova stenosi. Fino a che la milza rimane ingrossata, il paziente necessita di una terapia immunomodulante per controllare l' attività della malattia.
Un numero di condizioni apparentemente locali presentano un ingrossamento della polpa bianca splenica, fatto che indica il carattere invece sistemico della malattia, con autoantigeni che passano nel circolo ematico e causano una RI nella milza. In aggiunta al trattamento locale, le malattie seguenti richiedono un' immunomodulazione sistemica: pericardite autoimmune, colite ulcerosa, uveite "idiopatica", lichen planus e infiammazione cronica dell' orecchio interno, talora con coinvolgimento della sclera (sindrome di Cogan).
Tutte le malattie del collageno sistemiche coinvolgono la milza. Quest'organo è dunque l'indicatore ideale per valutare l'attività di malattie che costano al sistema sanitario pubblico un' enorme quantità di denaro, se i pazienti non ricevono un trattamento appropriato nelle fasi precoci del processo morboso. Per arrivare a una diagnosi precoce, e per i necessari costanti aggiustamenti della terapia, la valutazione della milza è fondamentale. Per prima cosa, una milza ingrossata permette di riconoscere una forma lieve e iniziale di AR, che colpisca poche articolazioni tipiche per AR, ma con un quadro ematico completamente normale e assenza di fattori sierici AR-specifici. Al contrario dell' AR, malattie come osteoartrite, artrite traumatica, sinovite da stress non producono una RI sistemica, e di conseguenza non coinvolgono la milza. Un intervento precoce è fondamentale per la gestione dell' AR. Se dobbiamo invece attendere di diagnosticare l' AR secondo i criteri classici, con ogni probabilità il processo morboso avrà già prodotto danni irreversibili.
Anche quando i pazienti con AR sono in remissione, la predisposizione genetica per la malattia è ancora presente. Un lieve trauma di un' articolazione colpita può bastare per condurre alla liberazione di autoantigeni (es. fibrina citrullinata) che, quando passano attraverso la milza, provocano una RI, suscettibile di produrre una ricaduta dell' artrite, specialmente nell' articolazione interessata. In maniera analoga, la chirurgia di un' articolazione colpita da AR libera automaticamente antigeni AR-specifici che passano nel sangue, e causano una RI nella milza, che porta a sua volta all' infiammazione dell' articolazione operata, per cui il trattamento locale sarà ovviamente insufficiente. Per prevenire tali esacerbazioni postoperatorie nell'AR, raccomandiamo una terapia endovenosa con 100 mg di metilprednisolone + 15 mg di methotrexate 8-10 giorni dopo l' intervento chirurgico.
Riassumendo, la valutazione della misura della milza è essenziale in tutte le malattie sistemiche autoimmuni per svelare un processo di RI, a prescindere dalla natura dell' autoantigene implicato. Ogniqualvolta la polpa bianca della milza si ingrandisce in questi pazienti, vi è necessità di un trattamento appropriato della loro malattia autoimmune.
Prima di accettare una milza ingrossata come indicatore della presenza di una malattia del collageno, si devono prendere in considerazione altre possibili cause di splenomegalia. Una causa comune è una gastroenterite acuta, che può produrre un ingrossamento della milza di breve durata (da pochi giorni a una settimana). La leishmaniosi Kala Azar, che è attualmente in aumento in Europa, produce una splenomegalia di notevole entità insieme a un' importante ipergammaglobulinemia. Due nostri pazienti hanno sviluppato una leishmaniosi, complicante un quadro clinico di LES. Entrambi i pazienti avevano una milza di oltre 18 cm. Nelle condizioni autoimmuni sistemiche, il contatto spleno-parietale non ha mai misurato nei nostri pazienti più di 12-13 cm. Altre cause di splenomegalia vanno talora considerate, come un linfoma o l'ipertensione portale.
Riguardo all' anemia mediterranea (talassemia minor), la taglia splenica complessiva risulta aumentata e facilmente riconoscibile con l' ecografia tradizionale , mentre il contatto della polpa bianca con la parete toraco-addominale si mantiene entro limiti normali.
CONCLUSIONE (
Torna Su)
La ricerca in immunologia sta procedendo a un passo troppo rapido da seguire per il clinico. Soprattutto con lo sviluppo dell' immunologia genetica, molecolare e cellulare, il messaggio pratico per il clinico può creare confusione o perdersi del tutto. In questa breve rassegna ho cercato di riassumere le tappe essenziali, necessarie al clinico per comprendere la crescente complessità del territorio dell' immunologia. Per il clinico, il problema si riduce alla valutazione della reazione immune nel tessuto linfatico, soprattutto nella milza.
Il nostro obiettivo finale è aiutare medici e pazienti a comprendere le malattie autoimmuni croniche sistemiche. Entrambi devono capire l'importanza di una corretta valutazione dei meccanismi di fondo e della conoscenza delle modalità d'azione dei vari agenti immunomodulanti. Un dialogo collaborativo contribuisce moltissimo al successo della cura. E' proprio doveroso che i pazienti sofferenti di malattie croniche siano bene informati circa la loro malattia e sulle caratteristiche dei farmaci loro prescritti. Medici e pazienti sono consapevoli della necessità di adeguare l' intensità del trattamento all' attività di una malattia cronica sempre soggetta a cambiamenti. Questo processo può condurre a una collaborazione duratura tra loro.
BIBLIOGRAFIA (
Torna Su)
1. Jenner Adw. London 1796
2. Von Behring E., Kitasato S. (1890) Serotherapie mit anti-diphterie Serum. Dtsch Med Wochschr 16:1113
3. Metalnikoff S. (1900) Etude sur la spermatoxine. Ann Inst Pasteur (Paris) 14:577
4. Ehrlich P., Morgenroth J. (1900) J. Berl Klin Wochschr 53:157
5. Landsteiner K. (1900) Zbl Bakt 27:357
6. Von Pirquet C. (1906) Allergie. Munch Med Wochschr 53:157
7. Chase M.W. (1945) The cellular transfer of cutaneous hypersensitivity. Proc Soc Exp Biol Med 59:134
8. Fagreus A. (1948) Antibody production in relation to th development of plasma cells: in vivo and in vitro experiments. Acta Med Scand Suppl 204:3
9. Glick B., Chang T.S., Jaap R.G. (1956) The bursa of Fabricius and antibody production. Poultry Sci 35:224
10. Miller J.F.A.P. (1961) The immunological function of the thymus. Lancet II:748
11. Miescher P.A., Fauconnet M. (1954) Mise en édence de difffèrents groupes leucocytaires chez l' homme. Schw Med Wochschr 84:597
12. Dausset J. (1958) Iso-leuko-antibodies. Vox Sang 13:240
13. Van Rood J.J., van Leewen A. (1976) Alloantigens in leukocytes and platelets. In Textbook Immunopathology, eds. Miescher P.Q. and Muller Eberhard H.J. Grune and Stratton, New York, p. 663
14. Benacerraf B., McDevitt H.O. (1972) The histocompatibility linked immune response genes. Science 175:273
14a. Zinkernagel R.M., Doherty P.C. (1974) Restriction of in vitro T cell-mediated cytotoxicity in lymphocytic choriomeningitis within a syngeneic or semiallogeneic system. Nature 248:701
15. Mosmann T.R., Coffman R.L. (1989) Th1 and Th2: different patterns of lymphokine secretion lead to different functional properties. Ann Rev Immunol 7:145
16. Chen Z., Tato C.M., Muul L., Laurence A., O'Shea J.J. (2007) Distinct regulation of interleukin-17 in human T helper lymphocytes. Arthritis and Rheumatism 56:2936
17. Miescher P.A., Zavota L., Ossandon A., Laganà. (2003) Autoimmune disorders: a concept of treatment based on mechanisms of disease. Springer Sem Immunopath 25:Suppl.1, S5
18. McGonagle D., Savic S., McDermott M.F. (2007) The NLR network and the immunological continuum of adaptive and innate immune-mediated inflammation against self. Sem Immunopath 29:303
19. Matzinger P. (2007) Friendly and dangerous signals: is the tissue in control? Nature Immunology 8:11
20. Morelli A.E., Thomson A.V. (2007) Tolerogenic dendritic cells and the quest for transplant tolerance. Nature Rev Immunol 7:610
21. Chauffard M.A., Vincent C. (1900) Hèmoglobinurie hèmolitique avec ictère polycholique aigue Semin Mèd 29:601
22. Coombs R.A., Mourant A.E., Race R.R. (1945) Detection of incomplete Rhesus agglutinins. A new test. Lancet II:15
23. Harrington W.I., Hollingsworth J.W., Moore C.V. (1951) Demonstration of a thrombocytopenic factor in the blood of patients with thrombocytopenic purpura. J Lab Clin Med 38:1
24. Miescher P.A., Cruchaud S., Hemmeler G. (1952) Nouvelles acquisitions concernant la pathogése de la thrombocytopée essentielle. Helv Med Acta 19:434
25. Miescher P.A. (1954) Leucopèenie chronique par "autoanticorps". Acta Haematologica 11:152
26. Hargraves M.M., Richmond H., Morton R. (1948) Presentation of two bone marrow elements: the tart cell and the LE cell. Proc Mayo Clinic 23:25
27. Haserick J.R., Bortz D.W. (1950) Blood factor in acute disseminated lupus erythematosus. Determination of gamma globulin as specific plasma fraction. Am J Med Sci 219:660
28. Miescher P.A., Fauconnet M. (1954) L' absorption du facteur LE par des noyaux cellulaires isolès Experientia 10:252
29. Miescher P.A., Straessle R. (1957) New serological methods for the detection of the LE-factor. Vox Sanguinis 2:283
30. Utz P.J., Hottelet M., Schur P.H., Anderson P. (1997) Proteins phosphorylated during stress-induced apoptosis are common targets for autoantibody production in patients with systemic lupus erythematosus. J Exp Med 185:843
31. Kuhn K.A., Kulik L., Tomooka B., Braschler K.J., Arend W.P., Robinson W.H., Holers W.M. (2006) Antibodies against citrullinated proteins enhance tissue injury in experimental autoimmune arthritis. J Clin Invest 116:961
Traduzione italiana dall'originale "The immune response in autoimmune diseases" del Dott. Antonio Piga.